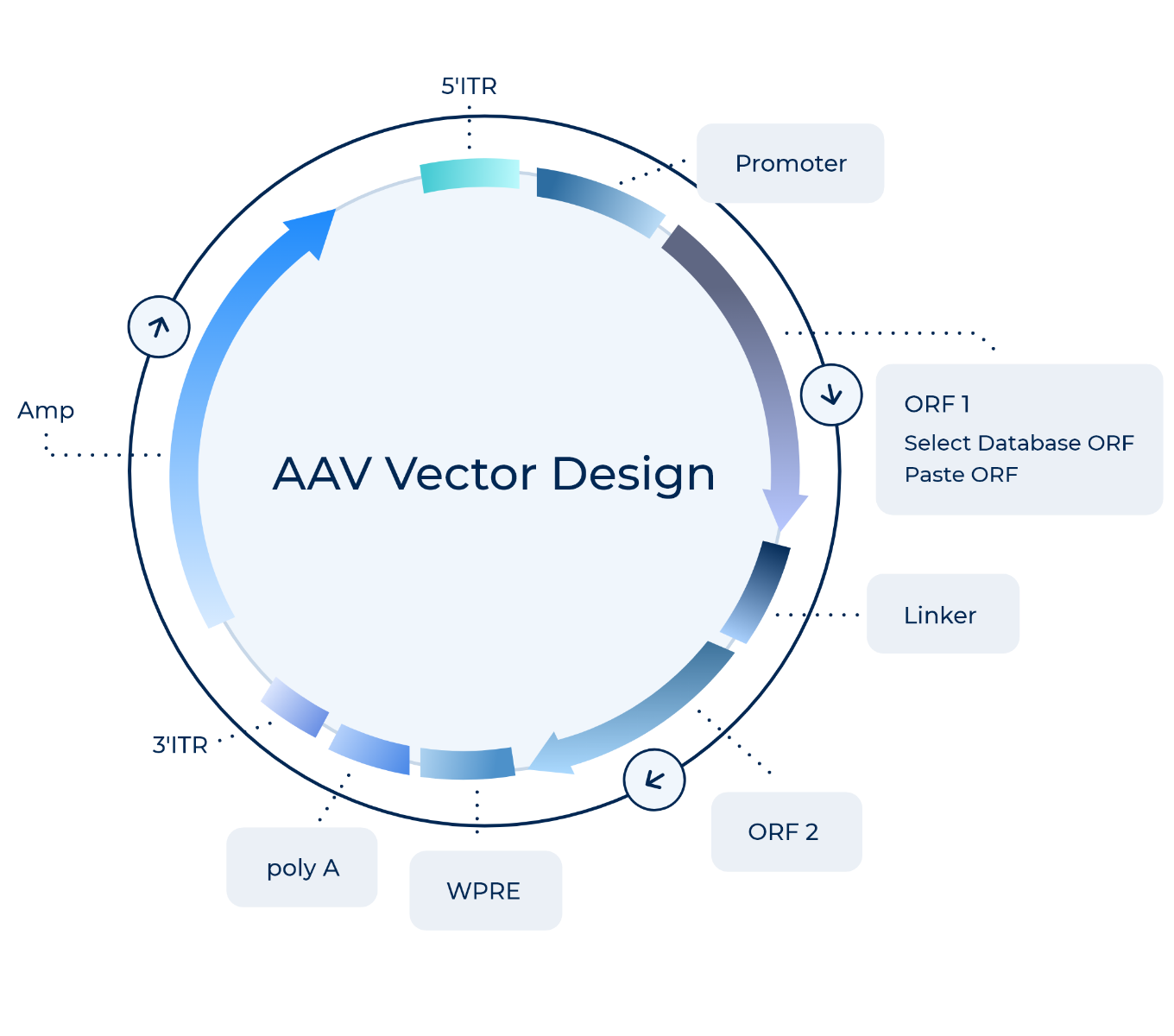
PackGene의 독자적인 AAV Cas9 발현 벡터는 SpCas9 또는 SaCas9, sgRNA, 또는 Cas9와 sgRNA를 하나의 벡터에서 동시 발현하도록 세심하게 설계되었습니다.
Available in piVector Designer
- SpCas9: dual vector or all-in-one vector
PackGene의 자체개발한 SpCas9 발현 벡터는 단일 AAV 벡터 내에서 SpCas9와 sgRNA를 동시 발현하도록 설계되었습니다. SpCas9 발현 서열이 AAV 벡터 삽입 길이 제한인 ~5Kb를 초과하지 않도록 하기 위해, 우리는 간결하고 효율적인 프로모터 서열인 EF1s 또는 miniCMV를 사용합니다. sgRNA 발현에는 효율적이고 상대적으로 짧은 H1 프로모터를 사용하여 sgRNA 발현 카세트의 전체 염기쌍 길이를 줄입니다. 이 전략을 통해 신뢰할 수 있고 효율적인 SpCas9와 sgRNA의 동시 발현이 가능한 단일 AAV CRISPR 벡터를 구축하였으며, 이를 통해 혼합된 세포 발현 형질의 위험과 일관성 없거나 오류 가능성이 있는 데이터의 가능성을 최소화합니다.
- SaCas9: dual vector or all-in-one vector
SaCas9는 SpCas9와 유사한 절단 활성을 유지하지만, SpCas9의 ~4.2kb에 비해 약 3.2kb의 더 짧은 유전자로 인코딩되는 Cas9의 짧은 버전입니다. 또한, SaCas9의 PAM 서열(NNGRRT)은 숙주 게놈에서 약 32bp마다 한 번씩 발생하여 빈도가 낮으며, 21-23nt의 표적 서열은 기존 SpCas9보다 깁니다. 이러한 감소된 PAM 빈도와 확장된 표적 서열 길이는 SaCas9의 더 높은결합 특이성에 기여하며, 이론적으로 기존 SpCas9에 비해 더 낮은 오프-타겟을 보입니다.
자세한 사항은 당사 기술 지원팀에 문의해 주시기 바랍니다.
- SpCas9HF
Hi-fidelity version of SpCas9
- SaCas9HF
Hi-fidelity version of SaCas9
- AAV-CRISPR gene activation MS2-P65-HSF1
일반적으로 Cas9는 표적 유전자 녹아웃을 하기 위해 기존의 sgRNA와 결합 되지만, 대체 기능을 위해 수정된 MS2 RNA 링커 스캐폴드를 포함하는 sgRNA와도 결합될 수 있습니다. 수정된 MS2 구성에서 SpCas9는 DNA 절단 능력을 상실하고 대신 MS2-P65-HSF1 전사 활성화 복합체를 모집하여 하류 유전자 전사를 촉진합니다. 이 접근 방식은 전사 활성화를 가능하게 하며, 내생 유전자 발현을 1000배 이상 증가시킬 수 있는 잠재력을 가지고 있습니다.
- NmCas9
3.3kb 길이의 NmCas9는 SpCas9와 유사한 활성을 가지지만, 특히 exceptionally 낮은 오프-타겟이 요구되는 응용 분야에서 장점을 제공하는 Cas9의 대체 버전입니다. NmCas9는 더 긴 PAM 서열(NNNNGATT)을 인식하며, 이는 SpCas9 PAM(약 128bp당 한 번 발생)보다 발생 빈도가 낮습니다. 21-23nt의 확장된 표적 서열 길이와 결합되어 더 높은 표적 특이성을 나타냅니다. 이러한 특성들은 NmCas9가 다른 Cas9 변이체 대비 이론적으로 더 낮은 오프-타겟 절단률을 가지도록 contribute하며, 이는 매우 정밀한 genome editing 응용 분야에 ideal하게 만듭니다.
- AsCpf1 and LbCpf1
Cas9와 그 변이체들이 가장 흔히 사용되는 CRISPR 효소 내부핵산효소이지만, Cpf1 내부핵산효소는 CRISPR 유전자 편집을 위한 대안으로 점점 더 인기를 얻고 있습니다. Cas9와 유사하게, Cpf1는 활성화를 위해 gRNA가 필요하며, PAM 서열 인접에 게놈 DNA에 결합하고, sgRNA 표적 서열 어닐링 후 DNA를 절단합니다. 그러나 Cpf1는 Cas9보다 크기가 더 작으며, 완전한 기능을 위해 더 짧은 sgRNA가 필요합니다. 또 다른 주요 차이점은 Cas9는 블런트 말단 DNA 절단을 생성하는 반면, Cpf1는 4-5염기쌍이 돌출된 점착 말단을 생성하여 오류가 적고 제어 가능한 유전자 삽입을 용이하게 한다는 점입니다.
What is CRISPR?
CRISPR은 표적 유전자를 녹아웃(knockout), 돌연변이 유발(mutate) 또는 과발현(overexpress)시키는 데 사용할 수 있는 최첨단 유전자 변형 도구입니다. CRISPR 기반 연구 전략은 그 강력한 성능과 비교적 직관적인 작용 메커니즘으로 인해 생물학 연구 분야 전반에 걸쳐 널리 활용되고 있습니다.
CRISPR 유전자 편집에는 세 가지 구성 요소가 필요합니다: (1) 가이드 RNA (gRNA), (2) Cas9 엔도뉴클레아제, (3) 표적 게놈 내의 프로토스페이서 인접 모티프(PAM). gRNA는 두 영역으로 구성된 단일 가닥 RNA 분자입니다: (1) 관심 유전자의 15-24bp 염기쌍 세그먼트와 상보적인 유전자 표적 서열, (2) Cas9에 결합하는 스캐폴드 영역. gRNA 스캐폴드 영역은 Cas9 엔도뉴클레아제에 결합하는 반면, gRNA의 상보적 호스트 DNA 결합 영역은 결합되지 않은 상태로 남아 있습니다. 그러면 Cas9-gRNA 복합체는 PAM이라고 하는 특정 2-6bp 염기 서열을 찾아 숙주 세포의 게놈 DNA를 스캔할 수 있습니다. Cas9-gRNA 복합체가 PAM 서열을 인식하면, gRNA의 유전자 표적 영역이 PAM 서열 인접의 호스트 DNA에 어닐링할 수 있습니다. gRNA 유전자 표적 영역의 성공적인 결합 후, Cas9는 PAM 서열에 인접한 호스트 DNA를 절단합니다.
Cas9 매개 DNA 절단은 일반적으로 DNA repair 후 유전자 전사 및 기능적 유전자 녹아웃에서 큰 손상을 초래합니다. 또는 절단은 정확한 DNA 돌연변이를 도입하거나, Cas9 절단 능력을 억제하는 동시에 전사 단백질을 유전자의 프로모터 영역에 모집하는 변형된 gRNA 스캐폴드 영역을 사용하여 유전자 발현을 활성화하는 데 사용될 수 있습니다. 중요한 것은, 표적 DNA 인식의 특이성으로 인해 거의 모든 유전자를 표적으로 하는 CRISPR 기반 유전자 편집 전략을 설계하는 것이 가능해집니다.
CRISPR 기반 유전자 편집을 위한 AAV 벡터의 설계와 제작은 어렵고 시간이 많이 소요될 수 있습니다. 그러나 당사의 전문 팀은 전달 즉시 실험需求에 사용할 수 있는 고품질 CRISPR-AAV를 제공하는 데 필요한 경험과 지식을 보유하고 있습니다.
The design and production of AAV vectors for CRISPR based gene editing can be both challenging and time-consuming. However, our professional team has experience and knowledge necessary to deliver high quality CRISPR-AAVs that are ready to use for your experimental needs immediately on delivery.