장점
-
엔도톡신 및 오염 관리
-
정밀하게 정량화된 역가, 유전체 복제 수 및 완전성
-
안전 위험을 줄이고 효능을 향상시키다
-
재현 가능한 결과
서비스 상세 내용
| AAV 타입 | Scale | 제작기간(영업일 기준) |
|---|---|---|
| 일반 캡시드(guaranteed yield) | 1E+13 GC~8E+15 GC | 17일 |
| 주문제작 캡시드(by volume) | Up to 100L with 30mL-200mL small scale test | 25일 |
AAV 수율은 혈청형 및 삽입 유전자에 따라 차이가 있습니다. 당사에서는 고수율 혈청형(1, 3b, 5, 7, 8, 9, Rh10)에 대해 보장된 패키지를 제공합니다. 기타 혈청형의 경우, 볼륨 기반 생산을 진행하며 필요한 생산량을 결정하기 위해 소규모 시험 생산을 수행할 수 있습니다. 자세한 내용은 기술 지원팀으로 문의해 주십시오.
품질 관리(QC) 기준
NHP 등급 AAV는 동물 연구에서의 부작용을 최소화하고 제품 품질을 보장하기 위해, 출고 전에 엄격한 품질 관리(QC) 검사를 거칩니다.
| Test | Method | QC Standard | |
|---|---|---|---|
| Standard QC | ddPCR | Measure titer, normalized to 1e13vg/ml | Standard capsids: Concentration and total quantity meet needs. Custom capsids: quantity based on production scale. |
| AAV Capsid size* | SDS-PAGE silver stain | Match capsid protein size | |
| Guarantee endotoxin | LAL | <1EU/ml | |
| Mycoplasma Detection | qPCR | Negative | |
| Bioburden | Direct inoculation | No growth | |
| AAV Genome integrity | CE(titer>1e+12vg/ml, volume >50ul) | Report | |
| Empty Capsid Rate | TEM | <20% | |
| Additional QC | AAV Genome sequencing | Nanopore | Report |
| Empty Capsid Rate | AUC | Report | |
| Endotoxin removal | LAL | <0.2EU/ml | |
| Residual Triton Analysis (bundle with endo removal) | HPLC | 5ppm | |
| Sterility test | Direct inoculation | No growth |
품질
-
NHP 연구를 위하여 AAV 품질, 순도 및 안전성에 관한 전면적인 테스트 진행
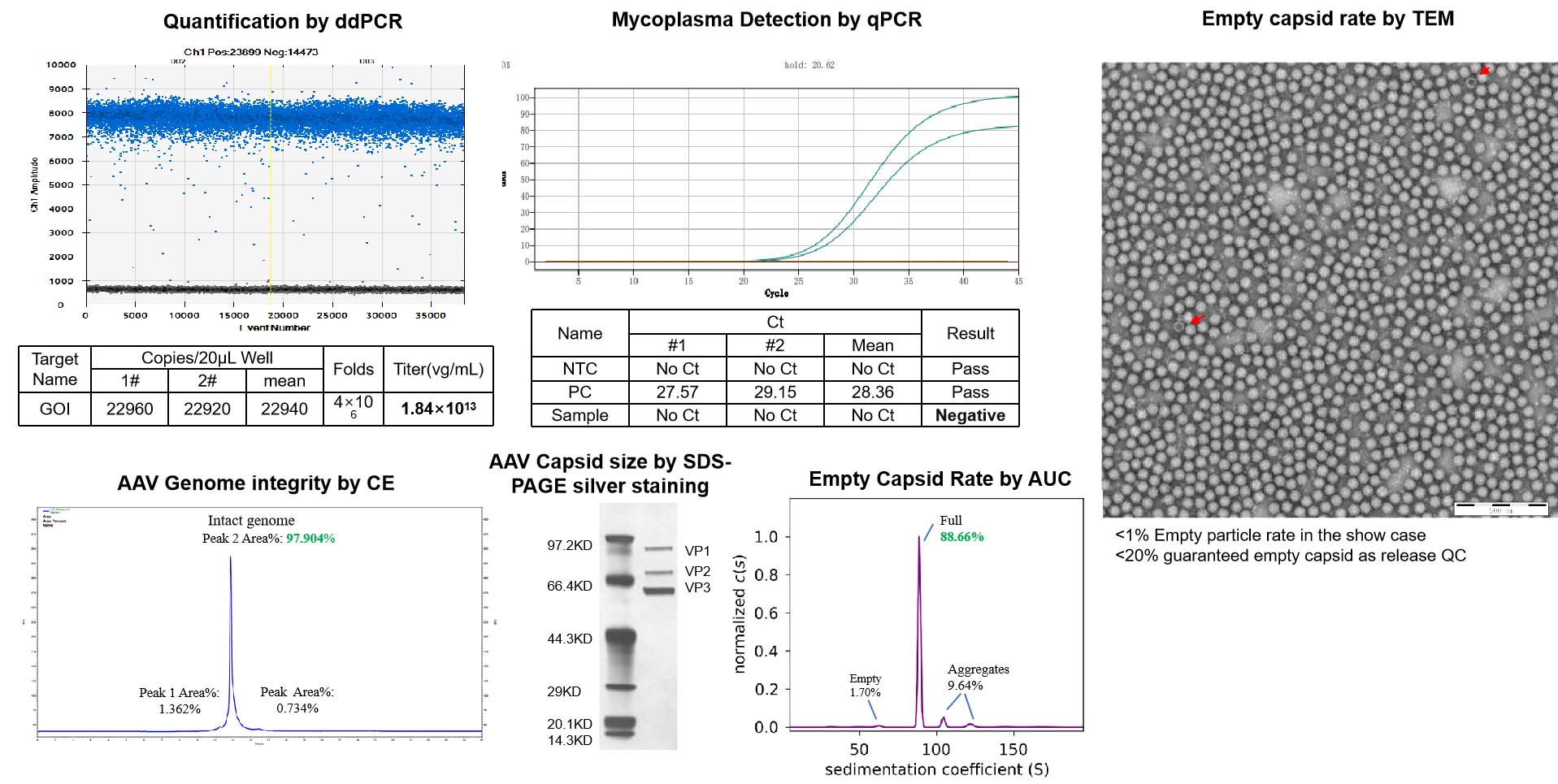
-
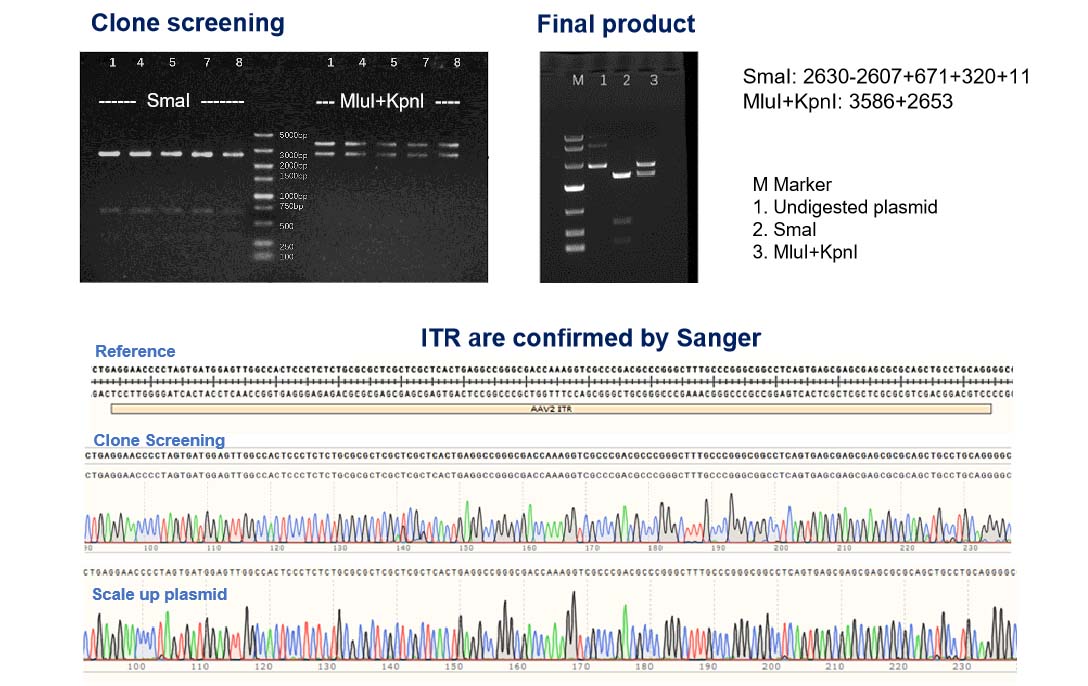
NHP 등급 AAV 생산을 위한 플라스미드 완전성 보장: ITR 및 목적 유전자(GOI) 이중 확인