장점
-
AAV 캡시드 엔지니어링
지향적 진화와 합리적 설계를 결합한 접근 방식 -
신뢰할 수 있는 데이터
동물 실험에서 얻은 통합된 실험 데이터 제공 -
독점적이며 기밀 유지 보장
검증된 변이 서열은 향후 프로젝트에서 제거되어 재사용되지 않습니다.
상세내용
What PackGene’s π-Icosa AAV Capsid engineering service can do?
- 표적 세포에 유전자 전달 특이성과 효율을 극대화합니다.
- 비의도적 표적 효과와 원치 않는 면역 반응의 위험을 최소화합니다.
- 특정 질병이나 상태를 더 정밀하고 효과적으로 치료하기 위한 암 및 유전질환 맞춤형 치료제 개발을 가능하게 합니다.
캡시드 엔지니어링 서비스에는 캡시드 라이브러리 설계 및 구축, 2회에 걸친 스크리닝, 그리고 최상위 변이체로 모델 동물에서의 최종 성능 검증도 포함됩니다. 스크리닝 기준, 동물 실험 및 기타 맞춤형 필요 사항에 대해서는 기술 지원팀과 상의하여 주시기 바랍니다.
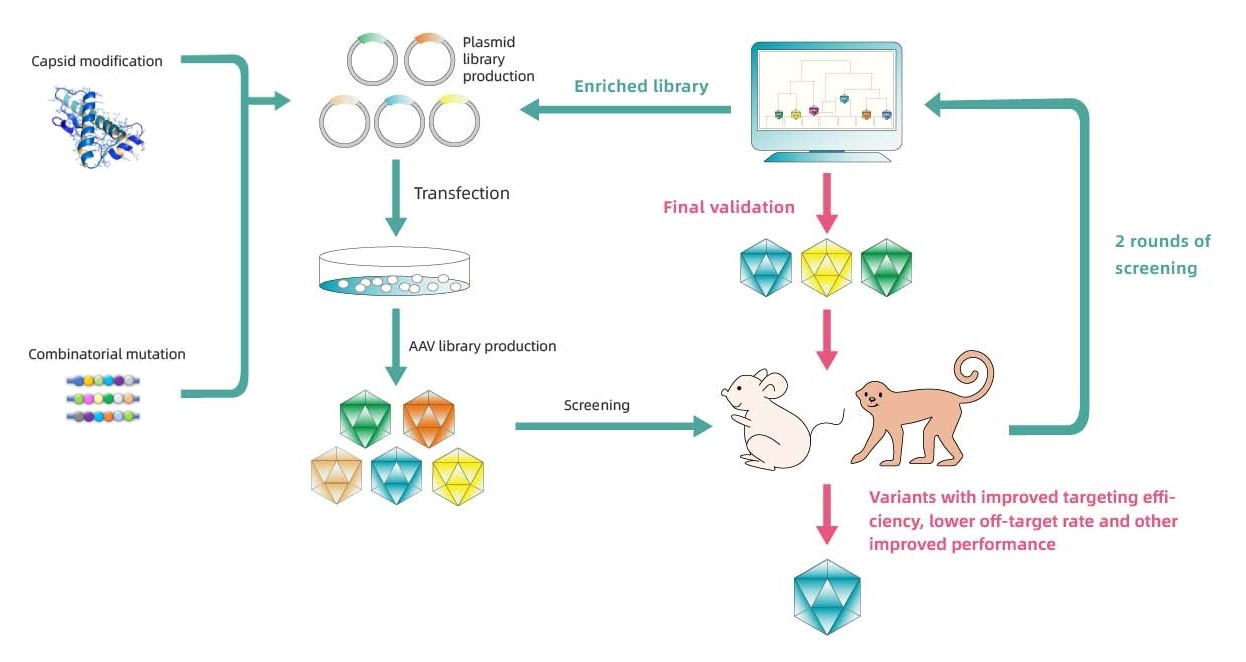
Detailed workflow of Capsid Engineering
PackGene은 AAV 캡시드 엔지니어링 플랫폼 π-Icosa 시스템을 개발하여, 맞춤형 요구에 따라 장기적으로 감염력이 향상되고 오프-타겟팅이 감소하거나 다른 특징을 가지는 AAV 캡시드 변이체 서열을 설계 및 스크리닝합니다. 이 과정은 GCT에서 잠재적으로 사용하기 위한 최상위 변이체를 식별하기 위해 동물에서의 AAV 캡시드 라이브러리 구축 및 스크리닝의 세 단계를 포함합니다. 1단계에서는 캡시드 라이브러리의 초기 구축, AAV 패키징, 동물 주입 및 동물 테스트를 포함하며, 필요한 경우 NGS 분석 및 2차 라이브러리 설계가 뒤따릅니다. 2단계는 유사한 프로세스를 따르지만 1단계 스크리닝 결과를 바탕으로 수정된 라이브러리로 시작하여 최상위 변이체를 식별합니다. 3단계에서는 최상위 변이체 플라스미드가 구축되고 AAV 패키징이 수행되며, 더 큰 규모로 동물 주입 및 테스트가 수행되고, 추가 요금 및 시간이 소요되지만 요청 시 조직학 검사를 이용할 수 있습니다. 이 과정은 GCT 개발을 위한 귀하의 필요에 따라 가장 효율적이고 특이적인 AAV 캡시드를 식별하는 것을 목표로 합니다. 자세한 내용은 π-Icosa 기술 플랫폼에서 확인
품질
-
Excellent Input Library Quality
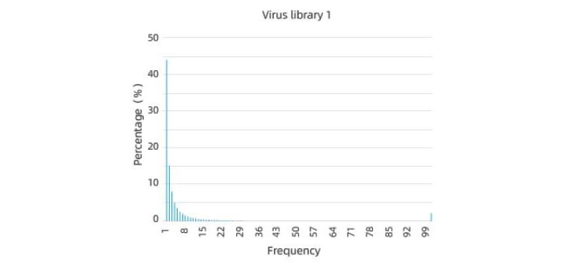
Excellent pre-screening library diversity and uniformity
높은 커버리지 라이브러리는 다양한 캡시드 변이체를 포함하고 있어, 원하는 특성을 가진 변이체를 발견할 가능성을 높입니다. 낮은 커버리지 라이브러리는 중요한 캡시드 변이체를 놓칠 수 있어 캡시드 엔지니어링의 가능성이 제한됩니다. 따라서 라이브러리가 다양하고 많은 서로 다른 변이체를 포함하도록 하는 것이 중요합니다.
균일성 또한 중요합니다. 이는 라이브러리 내 각 캡시드 변이체가 균일하게 패키징 되도록 보장하기 때문입니다. 불균일 할 경우 스크리닝 과정에 편향을 일으키고, 차선위 변이체의 선택으로 이어질 수 있습니다. 따라서 라이브러리가 균일하게 분포되고 각 변이체가 유사한 양으로 패키징 되도록 하는 것이 중요합니다.
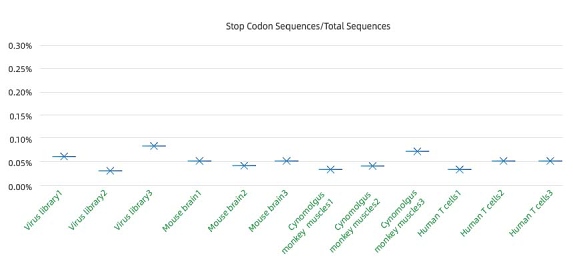
Extremely low mispackaging rate : <0.1%
캡시드 유전자가 조기 종결된 바이러스의 비율은 오패키징 비율의 핵심 지표입니다. 높은 오패키징 비율은 캡시드 혈청형과 실제 포함된 genome이 불일치하게 되어 스크리닝 결과의 오류를 초래합니다.
AAV 캡시드 엔지니어링에서는 캡시드를 개조하여 전달 효율이나 특이성을 개선하는 것을 목표로 합니다. 이를 달성하는 한 가지 방법은 다양한 AAV 변이체 라이브러리를 생성하고 원하는 특성을 갖는 변이체를 스크리닝하는 것입니다. 그러나 이러한 라이브러리에서 생산된 AAV 벡터의 오패키징율이 높을 경우, 스크리닝 결과가 부정확하고 신뢰할 수 없게 될 수 있습니다.
높은 오패키징 비율은 잘못된 유전 물질을 포함하는 AAV 벡터의 생산으로 이어질 수 있습니다. 이러한 벡터는 의도하지 않은 세포나 조직을 형질전환시켜 독성을 유발하거나 효능을 감소시킬 수 있습니다. 또한, 높은 수준의 오패키징은 rcAAV 입자의 형성을 초래할 수 있으며, 이는 바람직하지 않은 면역 반응을 일으키고 암 또는 유전질환 치료제의 안전성을 제한할 수 있습니다.
따라서 AAV 캡시드 엔지니어링에서 오패키징 비율을 최소화하는 것이 중요합니다. 이는 주입되는 DNA 양의 정밀 제어, 고품질 플라스미드 사용, 형질전환 조건 최적화와 같은 벡터 생산 공정을 개선함으로써 달성할 수 있습니다. 또한, 의도된 캡시드 라이브러리를 정확하게 대표하는 벡터가 실험되도록 패키징 오차에 대한 AAV 벡터의 신중한 스크리닝이 수행되어야 합니다.
오패키징률을 측정하기 위해, 당사는 전체 AAV 집단에서 캡시드 단백질이 조기 종결된 AAV의 비율을 측정합니다. 측정 결과, 극히 낮은 오패키징률을 확인하였으며, 이는 바이러스 패키징 과정에서 패키징된 AAV 캡시드 유전자와 캡시드 단백질의 정확한 일치를 보장하여 신뢰할 수 있는 스크리닝 결과로 이어집니다.
-
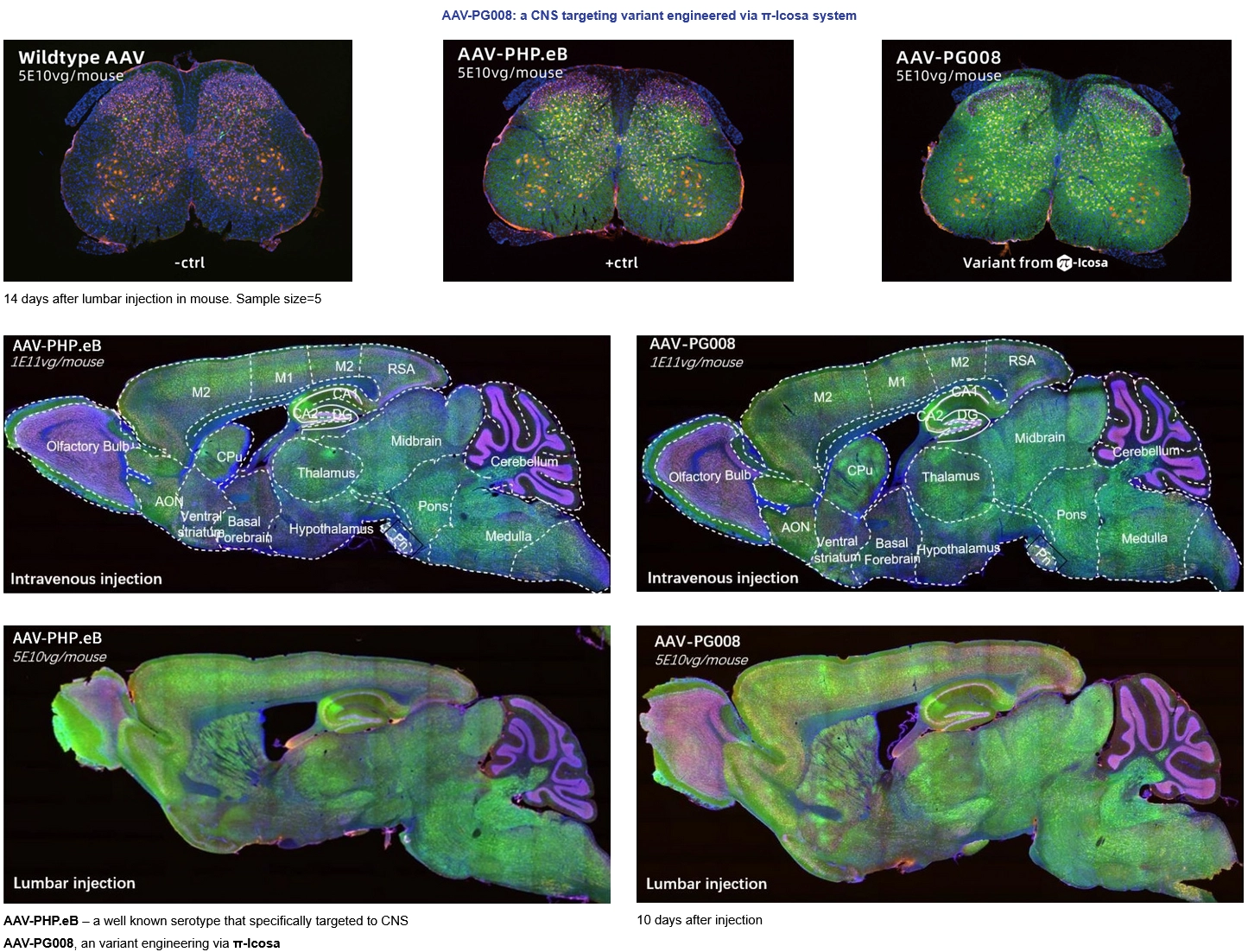
Novel Capsid screened from π-Icosa system target to CNS
-
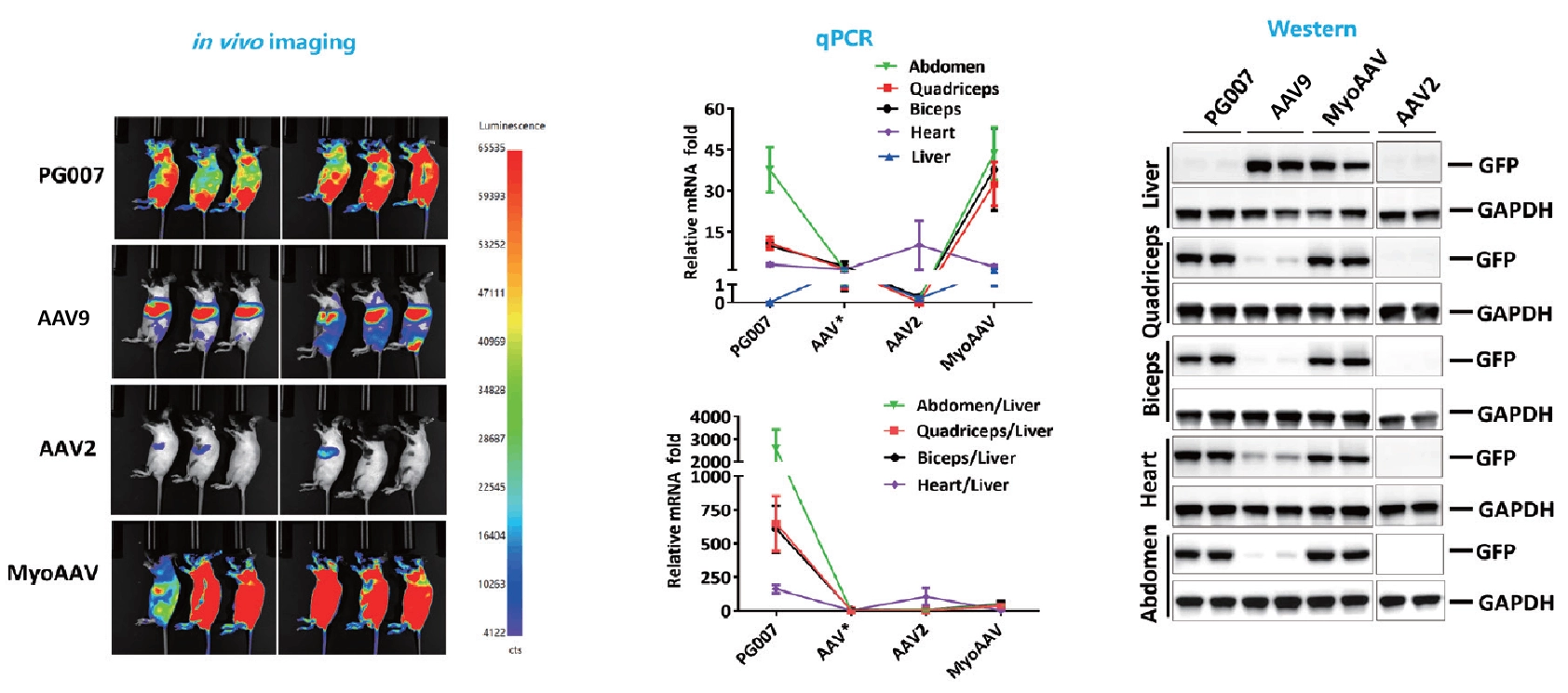
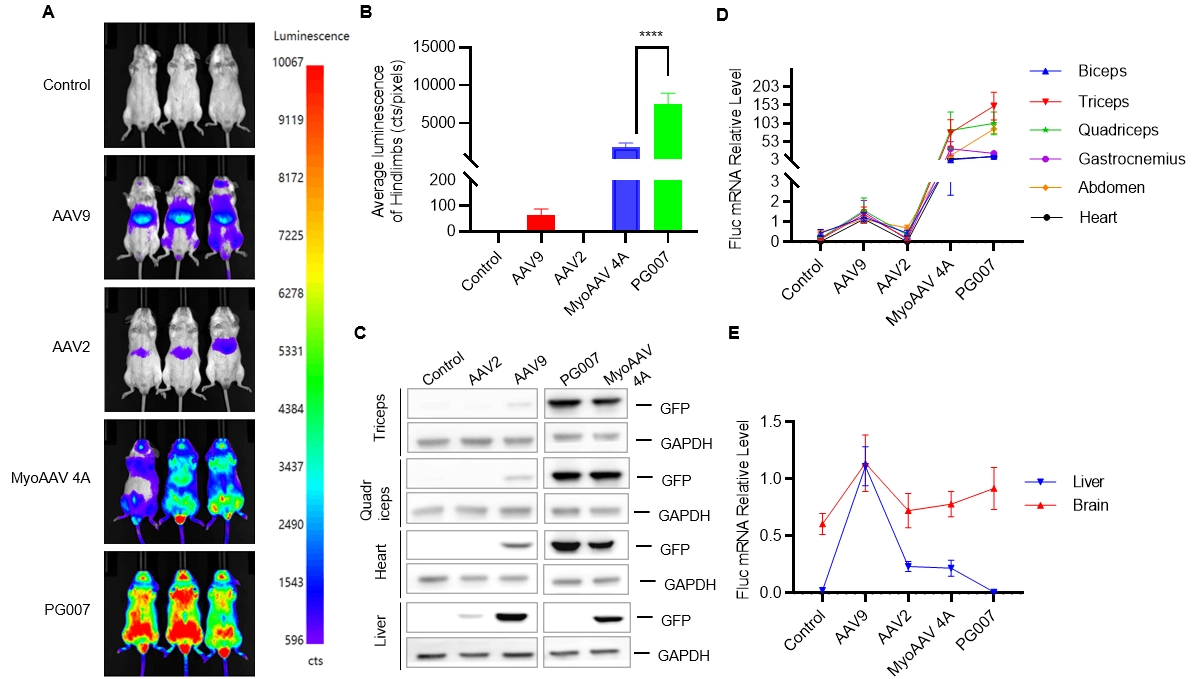
Novel capsid targeting muscle with liver-detargeting
-
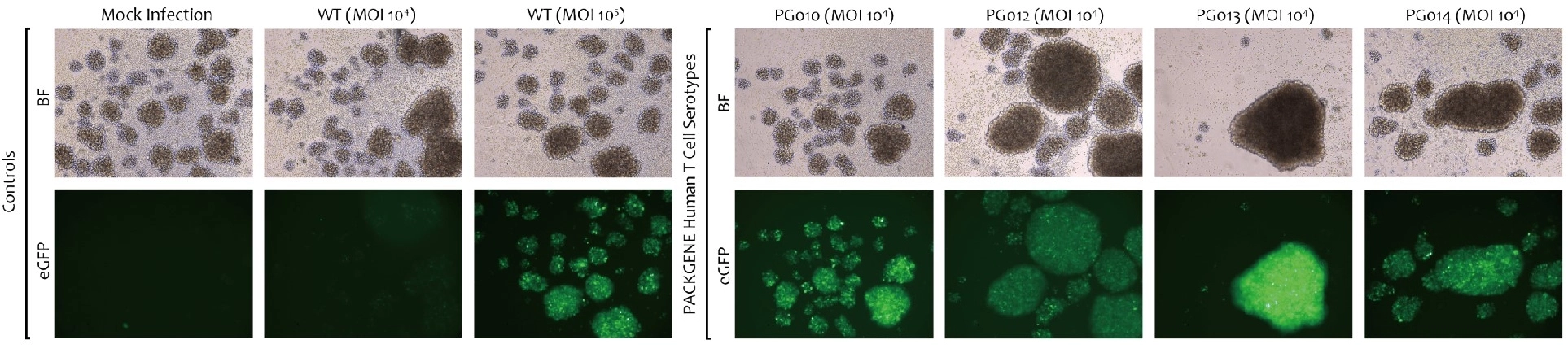
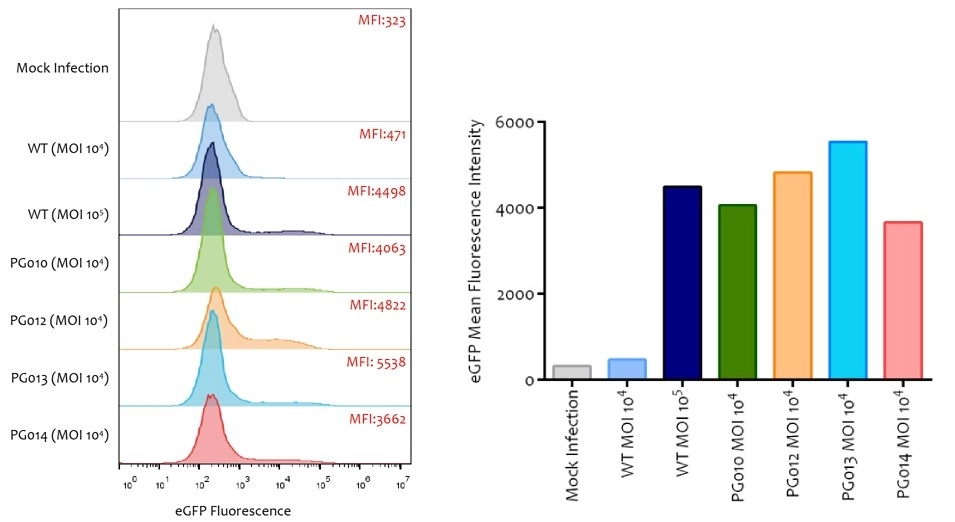
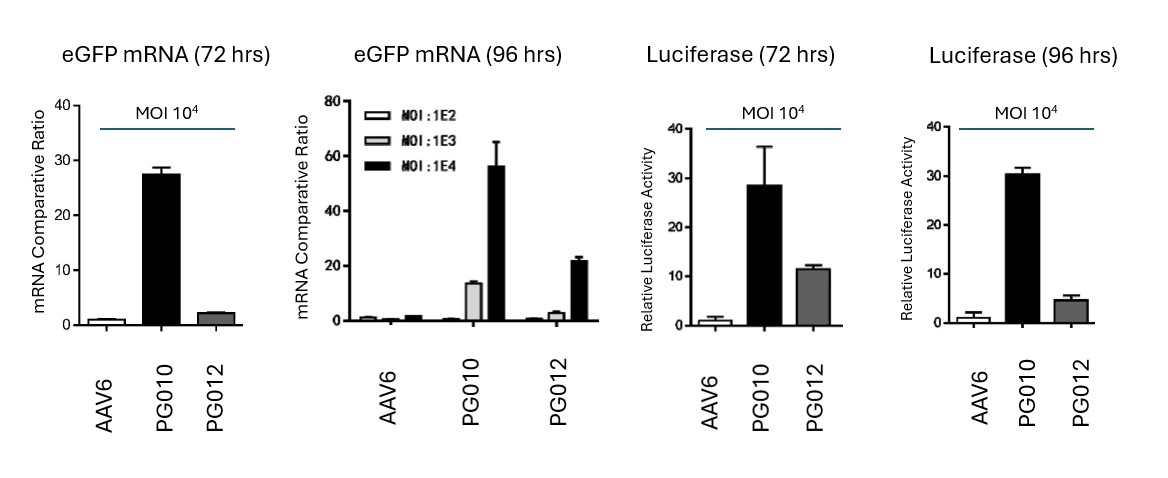
Novel capsid targeting primary human T cells